S01 E04 L'atome d'argent
Publié le jeu. 06 août 2020 dans PQT , modifié le:
Article précédent PQT SO1 E04 Article suivant
Pourquoi Stern et Gerlach ont-ils utilisé des atomes d'argent et pourquoi s'attendaient-ils à ce qu'ils se comportent comme de minuscules aimants dans leur expérience ?
Des motifs erronés mais instructifs
En 1922, on commençait tout juste à découvrir la mécanique quantique. C'est pourquoi, si les scientifiques de l'époque avaient raison de penser que les atomes d'argent pourraient se comporter comme de minuscules aimants, ils le pensaient pour de mauvaises raisons.
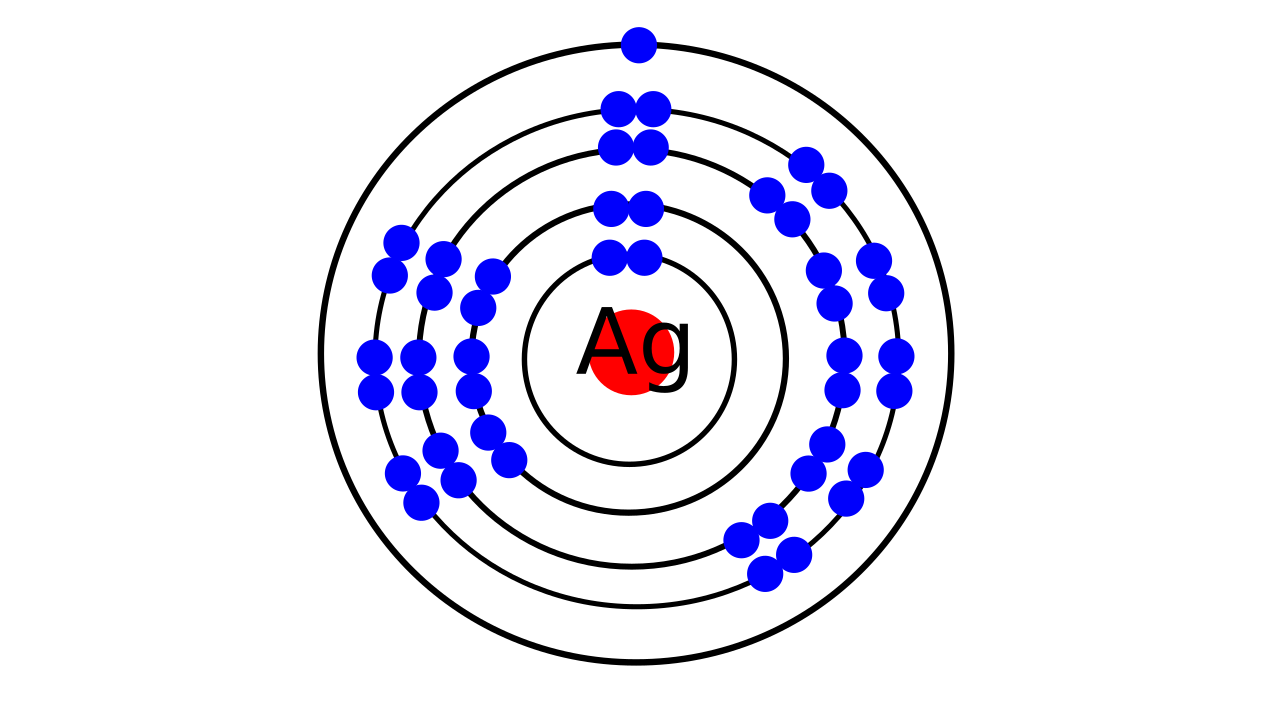
Schéma de l'atome d'argent
Mais ces mauvaises raisons, nous allons quand même les passer en revue maintenant. Pourquoi ?
- Parce qu'il est important d'essayer de suivre le raisonnement des scientifiques et que leurs erreurs sont souvent aussi riches d'enseignements que leurs succès.
- Parce que ces erreurs, dans notre cas, sont encore répandues y compris dans beaucoup de vulgarisations.
- Et enfin parce que nous aurons l'occasion de revenir réfléchir à leur sujet. En effet, la conception que se faisaient Stern et Gerlach de l'atome d'argent était encore une conception «classique». C'est à la suite de leurs travaux et de ceux des scientifiques de leur époque qu'on a compris à quel point le monde quantique est différent du monde classique. Eux, ils ne pouvaient pas encore le savoir.
Les modèles de Rutherford et Bohr
Bien que Démocrite, dans l'Antiquité, ait envisagé l'existence des atomes, les expériences qui prouvent leur existence n'ont pu être réalisées qu'à la fin du 19ème siècle.
L'atome de Rutherford et de Bohr
À l'époque de Stern et Gerlach, c'est le modèle de Rutherford, complété par Bohr en 1913, qui rend le mieux compte de toutes les découvertes de l'époque.
Ce modèle est au fond l'analogue au niveau atomique du mouvement des planètes autour du Soleil. Il conçoit en effet l'atome comme étant formé d'un noyau autour duquel tourneraient les électrons. Ces électrons sont imaginés comme étant des corpuscules, c'est à dire des sortes de petites billes microscopiques susceptibles de tourner non seulement autour du noyau mais aussi sur elles-mêmes.
Le modèle de Bohr est encore «presque» classique. En effet, il n'a qu'une seule caractéristique quantique, c'est que selon lui toutes les orbites ne sont pas possibles pour les électrons.
Curieusement, ce modèle de Bohr est encore parfois encore enseigné de nos jours alors qu'il a été a détrôné par celui de Schrödinger dès 1926 et que c'est toujours ce modèle de 1926 qui rend le mieux compte des phénomènes que nous étudions en ce moment. Bien sûr, d'autres progrès considérables ont été réalisés depuis, mais ils concernent principalement le noyau des atomes et pas le mouvement des électrons auquel nous allons nous consacrer maintenant. Pourquoi le modèle de Bohr garde-t-il cette célébrité ? Il y a en fait une raion pratique à cela. Il permet de réaliser des schémas mnémotechnique qui ne correspondent pas au véritable mouvement des électrons, mais qui permettent de se souvenir facilement de la structure électronique des atomes et de leurs différents niveaux d'énergie.
Mais en ce qui nous concerne, c'est pour une autre raison que nous allons prendre le temps de regarder de plus près ce modèle obsolète de 1913: Ce n'est en effet qu'après avoir compris les résultats de l'expérience de Stern et Gerlach et les autres progrès réalisés par la mécanique quantique entre 1913 et 1926 que nous pourrons vraiment comprendre en quoi le modèle atomique de Bohr est aujourd'hui obsolète.
Champ magnétique dans le modèle de Rutherford
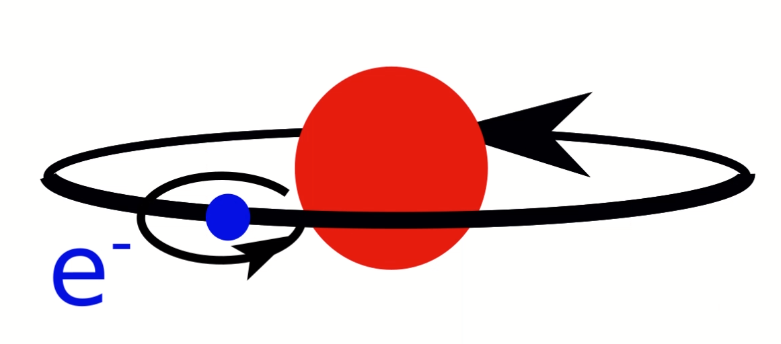
Dans le modèle de Rutherford, l'électron tourne autour du noyau. Ce faisant, il se comporte comme un courant électrique qui circule dans un bobinage, il génère un champ magnétique. C'est comme ça que fonctionnent tous les moteurs électriques. Le champ magnétique généré obéit à la «règle de la main droite»:
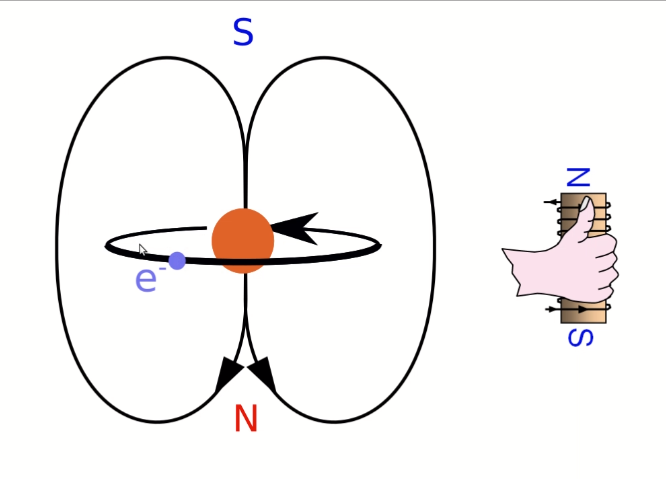
Si l'électron tournait autour du noyau
Si des charges positives circulent en faisant des boucles, on suit leur mouvement avec la main droite qui avance en se repliant le long des boucles. La direction du pouce indique alors le pôle Nord du champ magnétique ainsi généré.
Mais dans notre cas, ce sont des électrons, porteurs de charges négatives, qui sont sensés tourner autour du noyau. Il faut donc inverser la polarité, comme sur l'image ci-contre.
Bon, il y a quand même un problème avec ce modèle de Rutherford, et Bohr et les autres l'avaient bien vu. Si les électrons tournaient vraiment autour du noyau en générant un champ magnétique permanent et classique, ils devraient rayonner de l'énergie en permanence. Et du coup, perdant de l'énergie, ils devraient finir par tomber sur le noyau.
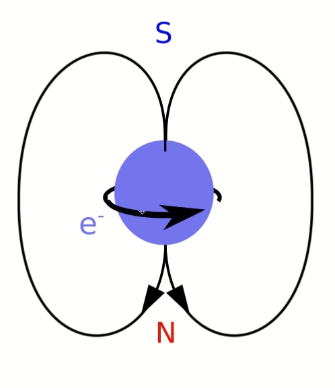
Si l'électron tournait sur lui-même
Mais nous ne discuterons pas de ce problème ici, ça nous entraînerait trop loin. Je le mentionne uniquement pour bien montrer qu'à l'époque de Stern et Gerlach, on était déjà très conscients qu'on n'en était qu'aux débuts des recherches en matière de mécanique quantique.
Imaginons maintenant que notre électron, non content de tourner autour du noyau, se mette en plus à tourner sur lui-même. Les mêmes causes produisant les mêmes effets, il générerait un champ magnétique supplémentaire.
C'est d'ailleurs en calculant ce champ magnétique supplémentaire que les scientifiques ont commencé à se rendre compte que quelque chose clochait dans ce modèle. Pour expliquer les effet observés, si l'électron était vraiment une petite bille tournant sur elle-même, il faudrait que son équateur tourne plus vite que la vitesse de la lumière. Or on sait depuis 1905 que c'est impossible.
Mais bon, faute d'avoir un modèle plus performant à l'époque, on va réfléchir et construire des expériences à partir de celui-ci. Au bout du compte, c'est la nature et elle seule qui nous donnera le résultats de nos expériences. Et c'est à partir de ces résultats que nous pourrons essayer de construire de meilleurs concepts.
Structure électronique
Regardons maintenant de plus près la structure électronique de l'atome d'argent. Elle est composée de 47 électrons répartis par paires ainsi:
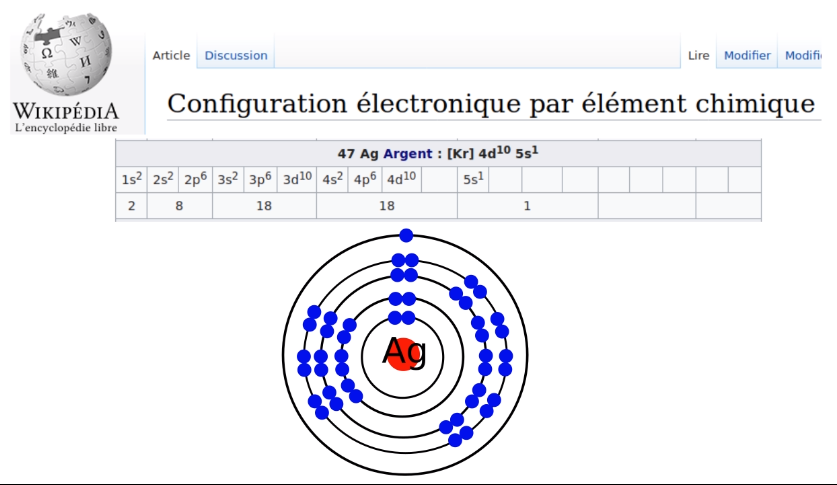
Structure électronique de l'atome d'argent
- 2 sur la première couche, la plus proche du noyau.
- 2 + 6 = 10 sur la deuxième
- 2 + 6 + 10 = 18 sur la troisième
- 2 + 6 + 10 = 18 aussi sur la quatrième
- et pour finir un électron tout seul sur la dernière couche.
C'est cet électron tout seul qui faisait penser que l'atome d'argent avait toutes les chances de se comporter comme un minuscule aimant. Pourquoi donc ?
Et bien parce que tous les autres électrons, s'ils sont "aimantés" vont avoir tendance à faire comme tous les aimants "bien élevés" du monde lorsqu'ils sont contraints de se placer côté à côte, c'est à dire à se mettre tête bêche.
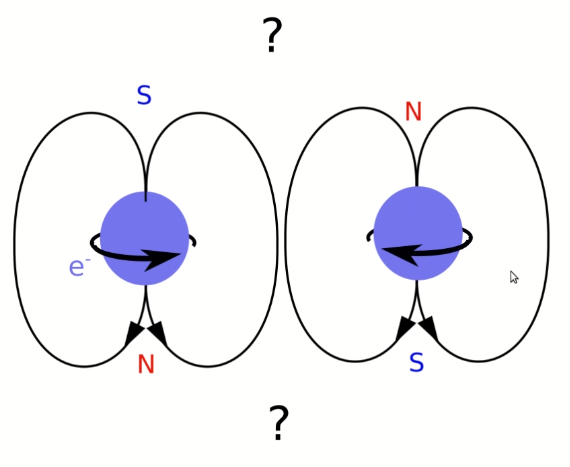
Champ magnétique d'une paire d'électrons
dans le modèle (obsolète!) de Rutherford
Or, s'ils se regroupent ainsi par paires, et on avait à l'époque toutes sortes de raisons de penser qu'ils faisaient quelque chose de ce genre. Leurs champs magnétiques opposés vont se neutraliser dès qu'on s'éloignera un peu d'eux. Mais même dans ce cas, il restera l'électron solitaire qui ne pourra trouver aucun partenaire.
D'une manière ou d'une autre, l'atome d'argent est donc un très bon candidat pour observer un champ magnétique élémentaire et c'est justement ce qu'on voudrait observer à l'époque de Stern et Gerlach, le comportement d'un possible champ magnétique élémentaire.
Mais franchement !!!
Mais franchement, me direz-vous, quel intérêt pour nous de consacrer du temps à ces modèles si nous savons par avance qu'il sont obsolètes ?
En fait, il y a une autre raison dont je ne vous avais pas encore parlé:
Quand nous aurons compris comme fonctionne le monde quantique, nous n'aurons fait que la moitié de notre voyage !
En effet, il nous faudra tôt ou tard revenir dans le monde de tous les jours et comprendre pourquoi le monde, à notre échelle, se comporte de manière «classique», si différente des comportements «quantiques» des ses composants élémentaires.
Et nous verrons en effet, dans la saison 2, par quelle sorte de "miracle" un grand nombre de particules élémentaires finit par se comporter de la manière «classique» habituelle. Déjà au niveau d'un simple atome d'argent, nous verrons bientôt que, bien qu'aucun des électrons ne se comporte de la manière classique imaginée par Rutherford, l'atome dans son ensemble se comporte de manière presque classique. Bien sûr, toute la subtilité est dans le «presque».
Mais chaque chose en son temps, il nous reste maintenant à comprendre la forme bizarre des aimants utilisés par Stern et Gerlach. Nous pourrons ensuite brancher l'expérience et admirer le résultat.
Article précédent PQT SO1 E04 Article suivant